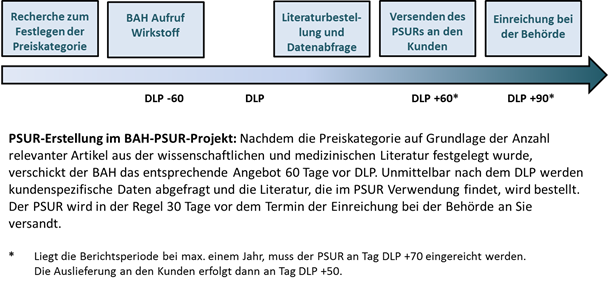
|
Im Rahmen der Erstellung des Gemeinschafts-PSURs übernimmt die Dr. Ebeling & Assoc. GmbH für Sie die Literaturrecherche in MEDLINE für die Berichtsperiode. Die PSUR-relevanten Publikationen werden zur Beurteilung des Nutzen-Risiko-Verhältnisses für den Wirkstoff aufbereitet.
Dafür werden u.a. Einzelfallberichte, klinische und präklinische Arbeiten, Reviews und Meta-Analysen berücksichtigt. Neben der sorgfältigen Evaluierung sicherheitsrelevanter Daten werden auch Informationen zu Efficacy und Effectiveness ausgewertet, wie es gemäß GVP-Modul VII gefordert wird. Als Referenzdokument werden in der Regel die Originator-SmPC oder das vom BfArM veröffentlichte Core Safety Profile (CSP), gegebenenfalls auch SmPC-Texte aus aktuellen Referrals, Ergebnisse von Bewertungen im Rahmen des PSUR Single Assessment und Public Assessment Reports (PARs), verwendet.
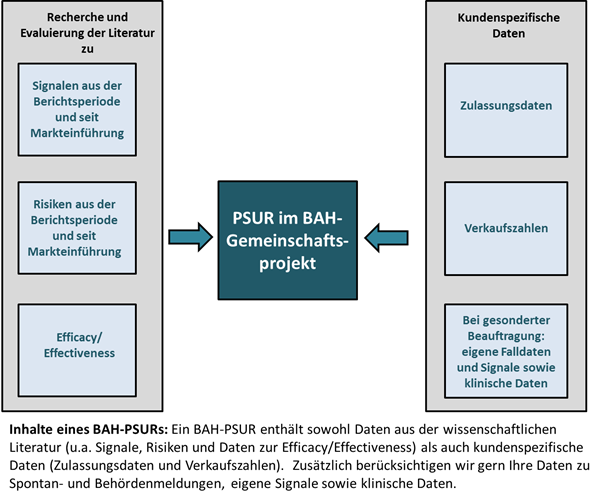
Ein im Rahmen des Pharma Deutschland-PSUR-Projekts erstellter PSUR beinhaltet neben den in der Literatur verfügbaren Daten auch individuelle Informationen wie die Zulassungsdaten und Verkaufszahlen während der Berichtsperiode sowie seit der Zulassung. Weitere firmenspezifische Daten, wie z.B. Spontanfälle und Behördenmeldungen können bei gesonderter Beauftragung eingearbeitet werden.
Die Signaldetektion und die kontinuierliche Nutzen-Risiko-Analyse basieren dann auf der sorgfältigen Auswertung aller Informationen. In diesem Zusammenhang ist zu beachten, dass jeder PSUR ein eigenständiges Dokument ist, in dem nicht nur die Berichtsperiode selbst, sondern auch kumulierte Daten seit Marktzulassung diskutiert werden.
Signal Detektion und kontinuierliche Nutzen-Risiko-Analyse für nicht-PSUR-pflichtige Substanzen
Laut der „Guideline on Good Pharmacovigilance Practices - Module VII - Periodic Safety Update Reports“ müssen Zulassungsinhaber auch für nicht-PSUR-pflichtige Substanzen eine kontinuierliche Nutzen-Risiko-Analyse (Continuous Benefit-Risk Assessment) vornehmen: „For the products where PSURs are no longer required to be submitted routinely, it is expected that marketing authorisation holders will continue to evaluate the safety of their products on a regular basis and report any new safety information that impacts on the benefit-risk profile or the product information.“ Diese Aussage wird durch die “Questions and Answers to support the implementation of the Pharmacovigilance legislation” (Version 3, Frage 5.27) unterstützt.
Die kontinuierliche Nutzen-Risiko-Analyse bieten wir Ihnen im Rahmen des Pharma Deutschland-Projekts Signal Management und CoBRA® an. Die Ergebnisse aus diesem Projekt können natürlich auch als Basis für die PSUR-Erstellung dienen.
Selbstverständlich stehen wir auch für die Erstellung des Addendum to the Clinical Overview und des Clinical Expert Statement im Rahmen von Zulassungsverlängerungen zur Verfügung.
Kontaktieren Sie uns gern für ein persönliches Angebot. |

